
HUMAFACTOR-9 1000 NE por és oldószer oldatos injekcióhoz
HUMAFACTOR-9 1000 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer a Humafactor-9 készítmény és milyen betegségek esetén alkalmazható?
A Humafactor-9 humán plazmából előállított IX. véralvadási faktort tartalmazó készítmény, amelyet a vérzés megelőzésére és kezelésére alkalmaznak, öröklött és szerzett IX-es faktor hiányos állapotokban (Hemofília B).
2. Tudnivalók a Humafactor-9 készítmény alkalmazása előtt
Ne alkalmazza a Humafactor-9 készítményt:
- ha allergiás a humán IX-es véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
A Humafactor-9 alkalmazása előtt beszéljen kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel.
Mint bármely intravénás fehérjekészítmény beadásánál, allergiás reakciók előfordulhatnak.
A Humafactor-9 a IX-es faktoron kívül nyomokban más emberi fehérjéket is tartalmaz.
Amennyiben a készítmény alkalmazása során az alább felsorolt tüneteket tapasztalja, az injekció beadását azonnal le kell állítani, és orvoshoz kell fordulni, mivel ezek egy allergiás reakció korai jelei lehetnek.
Az alábbi tünetek fordulhatnak elő:
- bőrkiütés,
- testszerte kialakuló csalánkiütés,
- mellkasi szorító érzés,
- nehézlégzés,
- vérnyomáscsökkenés,
- súlyos allergiás reakció (anafilaxia).
Sokk esetén a kezelőorvos a sokk-kezelés terápiás irányelvei szerint fog eljárni.
Ha Önnél szív- és érrendszeri kockázati tényezők állnak fenn, akkor a IX-es faktorral végzett pótló kezelés fokozhatja a szív- és érrendszeri kockázatot.
Amennyiben centrális vénás kanül szükséges a készítmény adásához, a centrális vénás kanüllel kapcsolatos szövődmények, köztük a helyi fertőzések, baktériumok véráramba kerülésének (bakterémia), valamint a kanül bevezetésének helyén az érben kialakuló vérrög (trombózis) kockázatát kezelőorvosának figyelembe kell venni.
Amennyiben már átesett heparin által kiváltott allergiás reakción, kerülnie kell a heparin tartalmú készítmények használatát.
Emberi vérplazmából előállított faktor IX. készítménnyel végzett többszöri kezelés után a betegek megfelelő monitorozása szükséges a neutralizáló antitestek (inhibitorok) képződésére irányulóan. Irodalmi adatok alapján összefüggés mutatható ki a IX-es faktor inhibitor jelenléte és a kezelés alatt felmerülő allergiás reakciók között. Ezért az allergiás reakciót mutató betegeknél gátló antitestek kimutatására irányuló vizsgálatot kell végezni. Megjegyzendő, hogy a IX-es faktorral szemben gátló antitestet képző betegeknél a következő kezelés alkalmával nagyobb az anafilaxia (súlyos allergiás reakció) kialakulásának kockázata.
A IX-es faktor készítmények alkalmazásához társuló allergiás reakciók kockázata miatt a IX-es faktor adagolásának megkezdése a kezelőorvos mérlegelésétől függ. Az első kezelés csak orvosi felügyelet mellett történhet, hogy az esetlegesen jelentkező allergiás reakciók gyors és hatékony kezelése biztosított legyen.
Tromboembólia
Tájékoztassa kezelőorvosát, ha Ön máj- vagy szívbetegségben szenved, vagy ha a közelmúltban jelentős műtéten esett át. A vérrögképződés veszélye miatt májbetegségben szenvedő betegeknél, sebészeti beavatkozást követően, újszülötteknél, illetve azon betegeknél, akiknél a disszeminált intravaszkuláris koaguláció (DIC) vagy más trombotikus jelenség kockázata áll fenn, a készítmény beadását követően a vérrögképződés jeleinek korai észlelése érdekében biológiai vizsgálatokra van szükség.
Minden ilyen esetben kezelőorvosa gondosan mérlegeli a Humafactor-9 alkalmazásának előnyét és kockázatát.
Vírusbiztonság
Emberi vérből vagy plazmából készült gyógyszerkészítmények előállítása során óvintézkedéseket vezettek be azért, hogy elkerüljék a fertőzések átvitelét a betegekbe. Ezen intézkedésekhez tartoznak:
- a vér- és plazmaadók gondos kiválasztása azért, hogy a fertőzést hordozó személyeket kizárják,
- a vérvétel mintájának egyedi vizsgálata és a plazmakeverékek vizsgálata vírus/fertőzés jeleire,
- olyan lépések beillesztése a gyártási folyamatba, amelyek képesek eltávolítani vagy inaktiválni a vírusokat.
Mindezen eljárások ellenére, emberi vérből vagy plazmából előállított gyógyszerek alkalmazásakor a fertőző betegségek átvitelének lehetősége nem zárható ki teljesen. Ez jelentheti akár eddig ismeretlen vagy új vírusok és más kórokozók átvitelét is.
Az alkalmazott eljárások hatékonynak tekinthetők a lipidburokkal rendelkező vírusokkal szemben, mint a humán immundeficiencia vírus (HIV), a Hepatitisz B vírus (HBV) és a Hepatitisz C vírus (HCV), valamint a lipidburokkal nem rendelkező Hepatitisz A vírusra (HAV). A lipidburokkal nem rendelkező vírusok, például a Parvovírus B19 vírus esetében ezen eljárások hatékonysága korlátozott lehet. A parvovírus B19-fertőzés veszélyes lehet terhességben (magzati fertőzés), illetve legyengült immunrendszerű betegekre és a vérszegénység bizonyos formáiban (például sarlósejtes vagy hemolitikus anémia) szenvedőkre.
Amennyiben IX-es faktorral történő rendszeres kezelésre szorul, kezelőorvosa elrendelheti a megfelelő védőoltások (Hepatitis-A, illetve Hepatitis-B) alkalmazását.
Minden egyes alkalommal, amikor Humafactor-9 kezelésben részesül, szigorúan ajánlott a készítmény nevének és gyártási számának dokumentálása, hogy a kezelésben részesülő személy és a gyártási tétel közötti kapcsolat rögzítésre kerüljön.
Gyermekek és serdülők
Elegendő adat hiányában a készítmény alkalmazása 6 éves kor alatt nem javasolt. A "Figyelmeztetések és óvintézkedések" részben felsoroltak a gyermekekre és serdülőkre is vonatkoznak.
Egyéb gyógyszerek és a Humafactor-9 készítmény
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Nem ismert az emberi plazmából származó IX-es véralvadási faktor koncentrátum interakciója egyéb gyógyszerekkel.
Ne használja egyidejűleg a Humafactor-9 készítményt más gyógyszerkészítményekkel.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel.
Állati reprodukciós vizsgálatokat IX-es faktor készítménnyel nem végeztek. Tekintettel arra, hogy a B típusú hemofília nőknél ritkán fordul elő, a IX-es faktor koncentrátumok terhességben vagy szoptatáskor történő alkalmazásával kapcsolatban nem állnak rendelkezésre adatok. Ezért az emberi vérplazma eredetű IX-es véralvadási faktor koncentrátumok terhességben és szoptatási időszakban csak egyértelmű indikáció esetén alkalmazandók.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Nem ismert, hogy a készítmény a fenti képességeket befolyásolná.
A Humafactor-9 nátriumot és heparint tartalmaz
Ez a gyógyszer legfeljebb 41 mg nátriumot (a konyhasó fő összetevője) tartalmaz üvegenként (10 ml), ami megfelel a nátrium ajánlott maximális napi bevitel 2,05%-ának felnőtteknél.
A készítmény heparint is tartalmaz, mellyel szemben ritkán megjelenhetnek allergiás reakciók. Ilyen betegek a továbbiakban nem kaphatnak heparin-tartalmú gyógyszert.
3. Hogyan kell alkalmazni a Humafactor-9 készítményt?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert.
Ha Önnek otthoni alkalmazásra írták elő a Humafactor-9 injekciót, gondosan kövesse orvosa, vagy a hemofília gondozó szakdolgozójának útmutatásait, valamint "A készítmény kezelésével kapcsolatos információk" rész utasításait. Amennyiben bizonytalan az alkalmazás módját illetően, kérjen segítséget orvosától, vagy a hemofília központ szakdolgozójától.
A kezelést hemofília ellátásban jártas orvos felügyelete alatt kell elkezdeni.
A készítmény ajánlott adagja
A IX-es faktor pótlás adagja és gyakorisága a IX-es faktor hiány mértékétől, a vérzés helyétől és kiterjedésétől, valamint az Ön klinikai állapotától függ.
A szükséges IX. faktor mennyiségét és az alkalmazás időtartamát olyan tényezők befolyásolják, mint az Ön testsúlya, betegségének súlyossága, a vérzés helye és mértéke, vagy az a körülmény, hogy egy operáció vagy vizsgálat alatt valószínűsíthető vérzést kell meggátolni. Ennek alapján fogja kezelőorvosa a beadandó Humafactor-9 mennyiségét meghatározni.
A kezelés során ajánlott a IX-es faktor szintjének ellenőrzése, aminek ismeretében a beadandó dózisok és az adagolás gyakorisága meghatározható. Elsősorban nagyobb sebészeti beavatkozások alkalmával feltétlenül szükség van a szubsztitúciós kezelés véralvadásra kifejtett hatásának laboratóriumi ellenőrzésére (IX-es faktor aktivitás mérésére). A betegek eltérően reagálhatnak a beadott IX-es faktorra, ami különböző hasznosulásban, illetve egyénileg változó felezési idő formájában nyilvánul meg.
Alultáplált, illetve túlsúlyos betegek esetén, a testtömegen alapuló adag módosítására lehet szükség.
További információk az adagolásról és a kezelési időről a Betegtájékoztató végén a kizárólag egészségügyi szakembereknek szóló részben találhatók.
Profilaxis
Súlyos hemofília B-ben szenvedő betegeknél a vérzéses események elleni hosszú távú profilaxisban a szokásos adag 20-40 NE faktor IX testtömegkilogrammonként, 3-4 napos időközökkel beadva. Néhány esetben, különösen fiatal pácienseknél, rövidebb időköz vagy magasabb dózis lehet szükséges.
Alkalmazása gyermekeknél és serdülőknél
A Humafactor-9 biztonságossága és hatásossága nem volt vizsgálva 6 év alatti gyermekek esetében.
Ha az előírtnál több Humafactor-9 készítményt alkalmazott
Humán IX-es faktor tartalmú készítmény túladagolásával kapcsolatos tüneteket nem jelentettek.
Túl nagy adag Humafactor-9 véletlen beadása esetén azonnal keresse fel az orvosát vagy a legközelebbi kórházat.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg orvosát vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A IX-es faktor adásával összefüggő ismert mellékhatások a Humafactor-9 alkalmazásakor is kialakulhatnak.
Ha az alábbi mellékhatások közül bármelyiket észleli, azonnal vegye fel a kapcsolatot orvosával vagy menjen a legközelebb eső kórház sürgősségi osztályára, vagy a hemofília központba:
- Hirtelen allergiás reakció (bőrkiütés, csalánkiütés, viszketés, arc-, ajak-, nyelv- vagy a test bármely részén jelentkező ödéma). Ezen mellékhatások ritkán alakulnak ki, ritkán súlyos allergiás reakcióhoz vezethetnek, beleértve az anafilaxiás sokkot is.
- Több esetben nefrózis szindrómát (súlyos vesebetegséget) jelentettek olyan hemofília B betegek esetében, akik a IX-es faktorral szemben gátló antitestet termeltek, kórtörténetükben a IX-es faktorral szembeni allergia szerepelt, és akiknél ezért immuntolerancia-indukciót kíséreltek meg.
- A hemofília B betegeknél IX-es faktort semlegesítő antitestek (inhibitorok) képződhetnek. Az ilyen inhibitorok képződése csökkent, nem megfelelő klinikai válaszban nyilvánul meg. Ilyen esetekben a megfelelő szakemberrel vagy szakintézménnyel való azonnali kapcsolatfelvétel javasolt.
- A IX-es faktor adásakor fennáll a vérrögképződés (tromboembolia) kockázata, különösen az alacsony tisztaságú készítmények esetén. Alacsony tisztaságú IX-es faktor készítmények alkalmazásakor több esetben figyeltek meg miokardiális infarktust, disszeminált intravaszkuláris koagulációt, vénás trombózist és tüdőembóliát. Nagy tisztaságú IX-es faktor készítmények alkalmazásakor ilyen mellékhatások csak ritkán fordulnak elő.
Egyéb mellékhatások:
-- égő, csípő érzés, bőrpír és duzzanat az injekció beadásának helyén
-- arc-, torok- vagy a test más részének vizenyője, hidegrázás, bőrkipirulás, csalánkiütés a test teljes felületén, egyéb bőrkiütés
-- fejfájás
-- alacsony vérnyomás, nyugtalanság, szapora szívverés, mellkasi szorító érzés
-- légszomj, zihálás, nehézlégzés
-- fáradtság, levertség
-- bizsergés vagy érzékelési zavar a végtagokon vagy a test más részein (paraesztézia)
-- émelygés, hányás
-- láz
Ezek a tünetek egyes esetekben súlyosabb anafilaxiás reakció (hirtelen fellépő súlyos allergiás reakció) és sokk kialakulásához vezettek, ami szoros időbeli összefüggésbe hozható volt a IX-es faktor elleni gátlótestek kialakulásával.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
Az átvihető ágensekkel kapcsolatos biztonság tekintetében lásd "2. Tudnivalók a Humafactor-9 készítmény alkalmazása előtt" pontot.
5. Hogyan kell a Humafactor-9 készítményt tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon feltüntetett lejárati idő (EXP) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható!
A fénytől és nedvességtől való védelem érdekében az eredeti csomagolásban tárolandó.
Felbontás után a készítményt azonnal fel kell használni.
Az injekciós üveg tartalmát egyszerre kell beadni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Humafactor-9 készítmény
- A készítmény hatóanyaga: plazma eredetű humán IX. véralvadási faktor
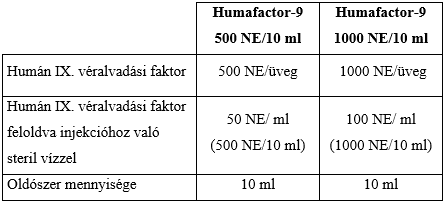
Minden üveg névlegesen 500 NE vagy 1000 NE humán IX. véralvadási faktort tartalmaz.
A mellékelt oldószerben feloldva milliliterenként kb. 50 NE (500 NE/10 ml) vagy 100 NE (1000 NE/10 ml) humán IX. véralvadási faktort tartalmaz.
A készítmény aktivitását (NE = nemzetközi egység) az Európai Gyógyszerkönyvben leírt egylépéses alvadási teszttel határozzák meg. A fajlagos aktivitása körülbelül 100 NE/mg fehérje.
Egyéb összetevők: nátrium-klorid, nátrium-citrát, glicin, nátrium-heparin, humán antitrombin III koncentrátum
Oldószer: injekcióhoz való steril víz
Milyen a Humafactor-9 külleme és mit tartalmaz a csomagolás
A Humafactor-9 készítmény hatóanyagot tartalmazó porból és hozzácsomagolt oldószerből áll. Feloldást követően intravénásan kerül beadásra.
Por: fehér vagy halványsárga liofilizátum.
Oldószer: tiszta, színtelen steril folyadék.
Humafactor-9 500 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: 500 NE IX-es faktor aktivitású fehér vagy halványsárga liofilizátum, halobutil gumidugóval, alumínium kupakkal és lepattintható műanyag fedéllel lezárt üvegben.
Oldószert tartalmazó injekciós üveg: 10 ml injekcióhoz való steril víz, halobutil gumidugóval, alumínium kupakkal és lepattintható műanyag fedéllel lezárt üvegben.
Humafactor-9 1000 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: 1000 NE IX-es faktor aktivitású fehér vagy halványsárga liofilizátum halobutil gumidugóval, alumínium kupakkal és lepattintható fedéllel lezárt üvegben.
Oldószert tartalmazó injekciós üveg: 10 ml injekcióhoz való steril víz, halobutil gumidugóval, alumínium kupakkal és lepattintható műanyag fedéllel lezárt üvegben.
A doboz tartalma:
- 1 db port tartalmazó injekciós üveg
- 1 db 10 ml oldószert tartalmazó injekciós üveg
- 1 db transzfer-szett
- 1 db 10 ml-es egyszer használatos fecskendő
- 1 db szárnyas tű
- 2 db alkoholos törlőkendő
- 1 db sebtapasz
A Humafactor-9 humán plazmából előállított IX. véralvadási faktort tartalmazó készítmény, amelyet a vérzés megelőzésére és kezelésére alkalmaznak, öröklött és szerzett IX-es faktor hiányos állapotokban (Hemofília B).
2. Tudnivalók a Humafactor-9 készítmény alkalmazása előtt
Ne alkalmazza a Humafactor-9 készítményt:
- ha allergiás a humán IX-es véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
A Humafactor-9 alkalmazása előtt beszéljen kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel.
Mint bármely intravénás fehérjekészítmény beadásánál, allergiás reakciók előfordulhatnak.
A Humafactor-9 a IX-es faktoron kívül nyomokban más emberi fehérjéket is tartalmaz.
Amennyiben a készítmény alkalmazása során az alább felsorolt tüneteket tapasztalja, az injekció beadását azonnal le kell állítani, és orvoshoz kell fordulni, mivel ezek egy allergiás reakció korai jelei lehetnek.
Az alábbi tünetek fordulhatnak elő:
- bőrkiütés,
- testszerte kialakuló csalánkiütés,
- mellkasi szorító érzés,
- nehézlégzés,
- vérnyomáscsökkenés,
- súlyos allergiás reakció (anafilaxia).
Sokk esetén a kezelőorvos a sokk-kezelés terápiás irányelvei szerint fog eljárni.
Ha Önnél szív- és érrendszeri kockázati tényezők állnak fenn, akkor a IX-es faktorral végzett pótló kezelés fokozhatja a szív- és érrendszeri kockázatot.
Amennyiben centrális vénás kanül szükséges a készítmény adásához, a centrális vénás kanüllel kapcsolatos szövődmények, köztük a helyi fertőzések, baktériumok véráramba kerülésének (bakterémia), valamint a kanül bevezetésének helyén az érben kialakuló vérrög (trombózis) kockázatát kezelőorvosának figyelembe kell venni.
Amennyiben már átesett heparin által kiváltott allergiás reakción, kerülnie kell a heparin tartalmú készítmények használatát.
Emberi vérplazmából előállított faktor IX. készítménnyel végzett többszöri kezelés után a betegek megfelelő monitorozása szükséges a neutralizáló antitestek (inhibitorok) képződésére irányulóan. Irodalmi adatok alapján összefüggés mutatható ki a IX-es faktor inhibitor jelenléte és a kezelés alatt felmerülő allergiás reakciók között. Ezért az allergiás reakciót mutató betegeknél gátló antitestek kimutatására irányuló vizsgálatot kell végezni. Megjegyzendő, hogy a IX-es faktorral szemben gátló antitestet képző betegeknél a következő kezelés alkalmával nagyobb az anafilaxia (súlyos allergiás reakció) kialakulásának kockázata.
A IX-es faktor készítmények alkalmazásához társuló allergiás reakciók kockázata miatt a IX-es faktor adagolásának megkezdése a kezelőorvos mérlegelésétől függ. Az első kezelés csak orvosi felügyelet mellett történhet, hogy az esetlegesen jelentkező allergiás reakciók gyors és hatékony kezelése biztosított legyen.
Tromboembólia
Tájékoztassa kezelőorvosát, ha Ön máj- vagy szívbetegségben szenved, vagy ha a közelmúltban jelentős műtéten esett át. A vérrögképződés veszélye miatt májbetegségben szenvedő betegeknél, sebészeti beavatkozást követően, újszülötteknél, illetve azon betegeknél, akiknél a disszeminált intravaszkuláris koaguláció (DIC) vagy más trombotikus jelenség kockázata áll fenn, a készítmény beadását követően a vérrögképződés jeleinek korai észlelése érdekében biológiai vizsgálatokra van szükség.
Minden ilyen esetben kezelőorvosa gondosan mérlegeli a Humafactor-9 alkalmazásának előnyét és kockázatát.
Vírusbiztonság
Emberi vérből vagy plazmából készült gyógyszerkészítmények előállítása során óvintézkedéseket vezettek be azért, hogy elkerüljék a fertőzések átvitelét a betegekbe. Ezen intézkedésekhez tartoznak:
- a vér- és plazmaadók gondos kiválasztása azért, hogy a fertőzést hordozó személyeket kizárják,
- a vérvétel mintájának egyedi vizsgálata és a plazmakeverékek vizsgálata vírus/fertőzés jeleire,
- olyan lépések beillesztése a gyártási folyamatba, amelyek képesek eltávolítani vagy inaktiválni a vírusokat.
Mindezen eljárások ellenére, emberi vérből vagy plazmából előállított gyógyszerek alkalmazásakor a fertőző betegségek átvitelének lehetősége nem zárható ki teljesen. Ez jelentheti akár eddig ismeretlen vagy új vírusok és más kórokozók átvitelét is.
Az alkalmazott eljárások hatékonynak tekinthetők a lipidburokkal rendelkező vírusokkal szemben, mint a humán immundeficiencia vírus (HIV), a Hepatitisz B vírus (HBV) és a Hepatitisz C vírus (HCV), valamint a lipidburokkal nem rendelkező Hepatitisz A vírusra (HAV). A lipidburokkal nem rendelkező vírusok, például a Parvovírus B19 vírus esetében ezen eljárások hatékonysága korlátozott lehet. A parvovírus B19-fertőzés veszélyes lehet terhességben (magzati fertőzés), illetve legyengült immunrendszerű betegekre és a vérszegénység bizonyos formáiban (például sarlósejtes vagy hemolitikus anémia) szenvedőkre.
Amennyiben IX-es faktorral történő rendszeres kezelésre szorul, kezelőorvosa elrendelheti a megfelelő védőoltások (Hepatitis-A, illetve Hepatitis-B) alkalmazását.
Minden egyes alkalommal, amikor Humafactor-9 kezelésben részesül, szigorúan ajánlott a készítmény nevének és gyártási számának dokumentálása, hogy a kezelésben részesülő személy és a gyártási tétel közötti kapcsolat rögzítésre kerüljön.
Gyermekek és serdülők
Elegendő adat hiányában a készítmény alkalmazása 6 éves kor alatt nem javasolt. A "Figyelmeztetések és óvintézkedések" részben felsoroltak a gyermekekre és serdülőkre is vonatkoznak.
Egyéb gyógyszerek és a Humafactor-9 készítmény
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Nem ismert az emberi plazmából származó IX-es véralvadási faktor koncentrátum interakciója egyéb gyógyszerekkel.
Ne használja egyidejűleg a Humafactor-9 készítményt más gyógyszerkészítményekkel.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel.
Állati reprodukciós vizsgálatokat IX-es faktor készítménnyel nem végeztek. Tekintettel arra, hogy a B típusú hemofília nőknél ritkán fordul elő, a IX-es faktor koncentrátumok terhességben vagy szoptatáskor történő alkalmazásával kapcsolatban nem állnak rendelkezésre adatok. Ezért az emberi vérplazma eredetű IX-es véralvadási faktor koncentrátumok terhességben és szoptatási időszakban csak egyértelmű indikáció esetén alkalmazandók.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Nem ismert, hogy a készítmény a fenti képességeket befolyásolná.
A Humafactor-9 nátriumot és heparint tartalmaz
Ez a gyógyszer legfeljebb 41 mg nátriumot (a konyhasó fő összetevője) tartalmaz üvegenként (10 ml), ami megfelel a nátrium ajánlott maximális napi bevitel 2,05%-ának felnőtteknél.
A készítmény heparint is tartalmaz, mellyel szemben ritkán megjelenhetnek allergiás reakciók. Ilyen betegek a továbbiakban nem kaphatnak heparin-tartalmú gyógyszert.
3. Hogyan kell alkalmazni a Humafactor-9 készítményt?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert.
Ha Önnek otthoni alkalmazásra írták elő a Humafactor-9 injekciót, gondosan kövesse orvosa, vagy a hemofília gondozó szakdolgozójának útmutatásait, valamint "A készítmény kezelésével kapcsolatos információk" rész utasításait. Amennyiben bizonytalan az alkalmazás módját illetően, kérjen segítséget orvosától, vagy a hemofília központ szakdolgozójától.
A kezelést hemofília ellátásban jártas orvos felügyelete alatt kell elkezdeni.
A készítmény ajánlott adagja
A IX-es faktor pótlás adagja és gyakorisága a IX-es faktor hiány mértékétől, a vérzés helyétől és kiterjedésétől, valamint az Ön klinikai állapotától függ.
A szükséges IX. faktor mennyiségét és az alkalmazás időtartamát olyan tényezők befolyásolják, mint az Ön testsúlya, betegségének súlyossága, a vérzés helye és mértéke, vagy az a körülmény, hogy egy operáció vagy vizsgálat alatt valószínűsíthető vérzést kell meggátolni. Ennek alapján fogja kezelőorvosa a beadandó Humafactor-9 mennyiségét meghatározni.
A kezelés során ajánlott a IX-es faktor szintjének ellenőrzése, aminek ismeretében a beadandó dózisok és az adagolás gyakorisága meghatározható. Elsősorban nagyobb sebészeti beavatkozások alkalmával feltétlenül szükség van a szubsztitúciós kezelés véralvadásra kifejtett hatásának laboratóriumi ellenőrzésére (IX-es faktor aktivitás mérésére). A betegek eltérően reagálhatnak a beadott IX-es faktorra, ami különböző hasznosulásban, illetve egyénileg változó felezési idő formájában nyilvánul meg.
Alultáplált, illetve túlsúlyos betegek esetén, a testtömegen alapuló adag módosítására lehet szükség.
További információk az adagolásról és a kezelési időről a Betegtájékoztató végén a kizárólag egészségügyi szakembereknek szóló részben találhatók.
Profilaxis
Súlyos hemofília B-ben szenvedő betegeknél a vérzéses események elleni hosszú távú profilaxisban a szokásos adag 20-40 NE faktor IX testtömegkilogrammonként, 3-4 napos időközökkel beadva. Néhány esetben, különösen fiatal pácienseknél, rövidebb időköz vagy magasabb dózis lehet szükséges.
Alkalmazása gyermekeknél és serdülőknél
A Humafactor-9 biztonságossága és hatásossága nem volt vizsgálva 6 év alatti gyermekek esetében.
Ha az előírtnál több Humafactor-9 készítményt alkalmazott
Humán IX-es faktor tartalmú készítmény túladagolásával kapcsolatos tüneteket nem jelentettek.
Túl nagy adag Humafactor-9 véletlen beadása esetén azonnal keresse fel az orvosát vagy a legközelebbi kórházat.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg orvosát vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A IX-es faktor adásával összefüggő ismert mellékhatások a Humafactor-9 alkalmazásakor is kialakulhatnak.
Ha az alábbi mellékhatások közül bármelyiket észleli, azonnal vegye fel a kapcsolatot orvosával vagy menjen a legközelebb eső kórház sürgősségi osztályára, vagy a hemofília központba:
- Hirtelen allergiás reakció (bőrkiütés, csalánkiütés, viszketés, arc-, ajak-, nyelv- vagy a test bármely részén jelentkező ödéma). Ezen mellékhatások ritkán alakulnak ki, ritkán súlyos allergiás reakcióhoz vezethetnek, beleértve az anafilaxiás sokkot is.
- Több esetben nefrózis szindrómát (súlyos vesebetegséget) jelentettek olyan hemofília B betegek esetében, akik a IX-es faktorral szemben gátló antitestet termeltek, kórtörténetükben a IX-es faktorral szembeni allergia szerepelt, és akiknél ezért immuntolerancia-indukciót kíséreltek meg.
- A hemofília B betegeknél IX-es faktort semlegesítő antitestek (inhibitorok) képződhetnek. Az ilyen inhibitorok képződése csökkent, nem megfelelő klinikai válaszban nyilvánul meg. Ilyen esetekben a megfelelő szakemberrel vagy szakintézménnyel való azonnali kapcsolatfelvétel javasolt.
- A IX-es faktor adásakor fennáll a vérrögképződés (tromboembolia) kockázata, különösen az alacsony tisztaságú készítmények esetén. Alacsony tisztaságú IX-es faktor készítmények alkalmazásakor több esetben figyeltek meg miokardiális infarktust, disszeminált intravaszkuláris koagulációt, vénás trombózist és tüdőembóliát. Nagy tisztaságú IX-es faktor készítmények alkalmazásakor ilyen mellékhatások csak ritkán fordulnak elő.
Egyéb mellékhatások:
-- égő, csípő érzés, bőrpír és duzzanat az injekció beadásának helyén
-- arc-, torok- vagy a test más részének vizenyője, hidegrázás, bőrkipirulás, csalánkiütés a test teljes felületén, egyéb bőrkiütés
-- fejfájás
-- alacsony vérnyomás, nyugtalanság, szapora szívverés, mellkasi szorító érzés
-- légszomj, zihálás, nehézlégzés
-- fáradtság, levertség
-- bizsergés vagy érzékelési zavar a végtagokon vagy a test más részein (paraesztézia)
-- émelygés, hányás
-- láz
Ezek a tünetek egyes esetekben súlyosabb anafilaxiás reakció (hirtelen fellépő súlyos allergiás reakció) és sokk kialakulásához vezettek, ami szoros időbeli összefüggésbe hozható volt a IX-es faktor elleni gátlótestek kialakulásával.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
Az átvihető ágensekkel kapcsolatos biztonság tekintetében lásd "2. Tudnivalók a Humafactor-9 készítmény alkalmazása előtt" pontot.
5. Hogyan kell a Humafactor-9 készítményt tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon feltüntetett lejárati idő (EXP) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható!
A fénytől és nedvességtől való védelem érdekében az eredeti csomagolásban tárolandó.
Felbontás után a készítményt azonnal fel kell használni.
Az injekciós üveg tartalmát egyszerre kell beadni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Humafactor-9 készítmény
- A készítmény hatóanyaga: plazma eredetű humán IX. véralvadási faktor

Minden üveg névlegesen 500 NE vagy 1000 NE humán IX. véralvadási faktort tartalmaz.
A mellékelt oldószerben feloldva milliliterenként kb. 50 NE (500 NE/10 ml) vagy 100 NE (1000 NE/10 ml) humán IX. véralvadási faktort tartalmaz.
A készítmény aktivitását (NE = nemzetközi egység) az Európai Gyógyszerkönyvben leírt egylépéses alvadási teszttel határozzák meg. A fajlagos aktivitása körülbelül 100 NE/mg fehérje.
Egyéb összetevők: nátrium-klorid, nátrium-citrát, glicin, nátrium-heparin, humán antitrombin III koncentrátum
Oldószer: injekcióhoz való steril víz
Milyen a Humafactor-9 külleme és mit tartalmaz a csomagolás
A Humafactor-9 készítmény hatóanyagot tartalmazó porból és hozzácsomagolt oldószerből áll. Feloldást követően intravénásan kerül beadásra.
Por: fehér vagy halványsárga liofilizátum.
Oldószer: tiszta, színtelen steril folyadék.
Humafactor-9 500 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: 500 NE IX-es faktor aktivitású fehér vagy halványsárga liofilizátum, halobutil gumidugóval, alumínium kupakkal és lepattintható műanyag fedéllel lezárt üvegben.
Oldószert tartalmazó injekciós üveg: 10 ml injekcióhoz való steril víz, halobutil gumidugóval, alumínium kupakkal és lepattintható műanyag fedéllel lezárt üvegben.
Humafactor-9 1000 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: 1000 NE IX-es faktor aktivitású fehér vagy halványsárga liofilizátum halobutil gumidugóval, alumínium kupakkal és lepattintható fedéllel lezárt üvegben.
Oldószert tartalmazó injekciós üveg: 10 ml injekcióhoz való steril víz, halobutil gumidugóval, alumínium kupakkal és lepattintható műanyag fedéllel lezárt üvegben.
A doboz tartalma:
- 1 db port tartalmazó injekciós üveg
- 1 db 10 ml oldószert tartalmazó injekciós üveg
- 1 db transzfer-szett
- 1 db 10 ml-es egyszer használatos fecskendő
- 1 db szárnyas tű
- 2 db alkoholos törlőkendő
- 1 db sebtapasz
Fogyasztói ár:
81848Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 81848 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2024
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2024

























