
FANHDI 250 NE por és oldószer oldatos injekcióhoz
ATC
VIII koagulációs faktor
Hatóanyag
factor VIII
FANHDI 250 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer a Fanhdi injekció és milyen betegségek esetén alkalmazható?
A Fanhdi liofilizált por oldatos injekcióhoz. 250 NE, ill. 500 NE, ill. 1000 NE humán VIII. véralvadási faktort tartalmaz injekciós üvegenként.
A készítmény kb. 25 NE, ill. 50 NE, ill. 100 NE humán VIII. véralvadási faktort tartalmaz milliliterenként a 10 ml injekcióhoz való vízben történő feloldás után.
A Fanhdi a VIII. véralvadási faktort tartalmazó vérzéscsillapító készítmények csoportjába tartozik.
A Fanhdi hemofília A-ban (öröklött VIII. faktorhiány) kialakult vérzés kezelése vagy megelőzése alkalmazható.
A készítmény alkalmazható a szerzett (egyéb betegség/tényező miatt kialalkuló) VIII. faktorhiány kezelésére is.
Nem állnak rendelkezésre olyan adatok, melyek alapján a Fanhdi von Willebrand-betegség kezelésére ajánlható lenne.
2. Tudnivalók a Fanhdi injekció alkalmazása előtt
Ne alkalmazza a Fanhdi injekciót:
- ha allergiás a humán VIII. véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt)egyéb összetevőjére.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Figyelmeztetések és óvintézkedések
A Fanhdi alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
- Kevéssé valószínű, de fennáll annak a lehetősége, hogy súlyos anafilaxiás reakció (hirtelen kialakuló, súlyos allergiás reakció) jelentkezik. Az alábbi tünetek lehetnek a Fanhdi hatására kialakult anafilaxiás reakció jelei: bőrkiütés, testszerte jelentkező csalánkiütés, szorító érzés a mellkasban, szédülés, hányinger vagy hányás, szédülés álló helyzetben. Ha ezeket a tüneteket tapasztalja, azonnal hagyja abba a készítmény használatát és kérjen orvosi segítséget.
- Orvosa valószínűleg el fog végezni néhány vizsgálatot, hogy meggyőződjön arról, hogy a Fanhdi adag, amit Ön kap, elegendő a megfelelő VIII. faktorszint fenntartásához.
- Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII. faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem kontrollálható Önnél, illetve gyermekénél a Fanhdi-val, azonnal tájékoztassa erről kezelőorvosát.
- Ha önnél korábban VIII. faktor-inhibitorok alakultak ki és másik VIII. faktorkészítményre tér át, fennáll az inhibitorok újbóli kialakulásának kockázata.
- Ha a Fanhdi alkalmazásához szükség van centrális vénás hozzáférést biztosító eszközre (central venous access device - CVAD), akkor orvosának oda kell figyelnie a CVAD-vel kapcsolatos szövődményekre, köztük a helyi fertőzésekre, a baktériumok megjelenésére a vérben (bakterémia) és a katéter bevezetési helyén kialakuló vérrögképződésre (trombózis).
Az emberi vérből vagy plazmából előállított gyógyszerek gyártása során bizonyos intézkedéséket tesznek annak érdekében, hogy elkerüljék a fertőzések átvitelét a betegre. Ezen óvintézkedések közé tartoznak az alábbiak:
- a donorok gondos kiválasztása, annak érdekében, hogy akik a fertőzések átvitele szempontjából kockázatot jelentenek, azokat kizárják,
- az egyes vérminták és plazmakészletek vizsgálata vírusok/fertőzések jeleire,
- a vírusok hatástalanítására/eltávolítására szolgáló lépések beiktatása a gyártási eljárásba.
Az emberi vérből vagy plazmából készült gyógyszerkészítmények alkalmazása esetén, mindezek ellenére sem zárható ki teljes bizonyossággal a fertőzés átvitelének lehetősége. Ugyanez érvényes az ismeretlen vagy új vírusokra és egyéb kórokozókra.
Ezek az intézkedések hatásosak a burokkal rendelkező vírusok, például a humán immundeficiencia vírus (HIV), a (májgyulladást okozó) hepatitisz B és hepatitisz C vírus, valamint a burokkal nem rendelkező hepatitisz A vírus esetén. Az intézkedések hatékonysága korlátozott lehet a lipidburokkal nem rendelkező vírusok, pl. a parvovírus B19 ellen. A parvovírus B19 fertőzés veszélyes lehet terhes nőkre (magzati fertőzés), valamint immunhiányos betegekre és bizonyos típusú vérszegénység esetén (pl. sarlósejtes vérszegénységben vagy hemolitikus anémiában).
Ha rendszeresen kap humán plazmából előállított VIII. faktorkészítményt, kezelőorvosa lehet, hogy ajánlani fogja a hepatitisz A és B elleni védőoltást.
Ajánlott, hogy minden esetben, mikor Fanhdi-kezelésben részesül, a készítmény nevét és gyártási számát feljegyezze.
Lásd még 4. pont.
Gyermekek és serdülők
A felsorolt figyelmeztetések és óvintézkedések felnőttekre és gyermekekre is vonatkoznak.
Egyéb gyógyszerek és a Fanhdi
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
A humán VIII. véralvadási faktorkészítmények és egyéb gyógyszerek közötti kölcsönhatás nem ismert.
Terhesség, szoptatás és termékenység
A hemofília A nőkben ritkán fordul elő, emiatt a VIII. faktor terhesség és szoptatás alatti alkalmazásáról nincsen tapasztalat.
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Nincs arra utaló jel, hogy a Fanhdi hatással lenne a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre.
A Fanhdi nátriumot tartalmaz
A Fanhdi gyártási eljárásából származó maradék nátriumtartalom nem haladja meg az injekciós üvegenkénti 23 mg-ot. Ez megfelel a felnőttek számára ajánlott maximális napi nátriumbevitel 1,15%-ának. Azonban a beteg testtömegétől és az adagolástól függően a beteg egy injekciós üvegnél többet is kaphat.
3. Hogyan kell alkalmazni a Fanhdi injekciót?
Az alkalmazott Fanhdi mennyisége több tényezőtől függ, pl. az Ön testsúlyától, klinikai állapotától, a vérzés helyétől és mértékétől. A szükséges VIII. faktor-aktivitási szint eléréséhez szükséges Fanhdi adagot és az alkalmazás gyakoriságát kezelőorvosa fogja kiszámítani.
A készítményt intravénásan (vénába fecskendezve), legfeljebb 10 ml/perc sebességgel kell alkalmazni.
A kezelés időtartamát kezelőorvosa fogja meghatározni.
A kezelésre és alkalmazásra vonatkozó útmutatások
Kövesse az alábbi utasítást, hacsak kezelőorvosa más útmutatást nem adott.
A maradék készítményt nem szabad későbbi kezelésre félretenni, még hűtőszekrényben tárolva sem.
Az oldat elkészítése:
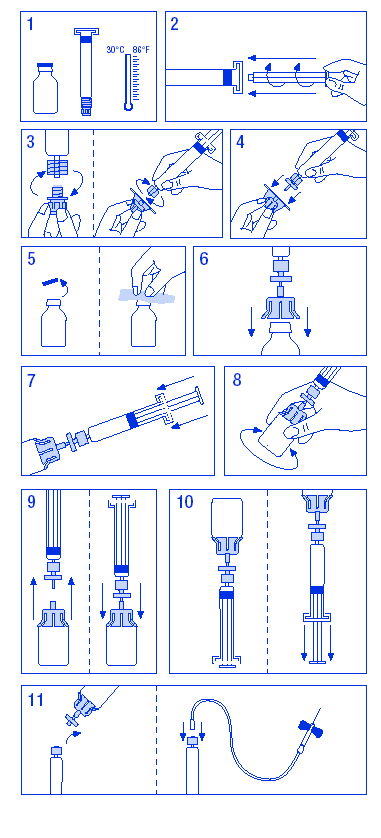
1. Melegítse fel az üvegeket maximum 30 °C-ra. (lásd 1. ábra)
2. Csatlakoztassa a dugattyút az oldószert tartalmazó fecskendőhöz. (lásd 2. ábra)
3. Vegye ki a szűrőt a csomagolásából. Vegye le a fecskendőről a zárókupakot, és csatlakoztassa a fecskendőt a szűrőhöz. (lásd 3. ábra)
4. Vegye ki az áttöltő adaptert a csomagolásból, és csatlakoztassa a szűrőhöz és a fecskendőhöz. (lásd 4. ábra)
5. Távolítsa el a kupakot az injekciós üvegről, és törölje le a dugót a mellékelt alkoholos törlővel. (lásd 5. ábra)
6. Szúrja át a dugót az áttöltő adapter tűjével. (lásd 6. ábra)
7. A teljes oldószer mennyiséget nyomja át a fecskendőből az injekciós üvegbe. (lásd. ábra)
8. Rázogassa óvatosan az injekciós üveget mindaddig, amíg a készítmény fel nem oldódik. (lásd 8. ábra) Egyéb parenterálisan alkalmazandó készítményekhez hasonlóan ne használja fel az oldatot, ha az oldódás nem tökéletes vagy az oldatban részecskék láthatók.
9. Rövid időre válassza szét a fecskendőt és a szűrőt az injekciós üvegtől és az áttöltő adaptertől, hogy a vákuum megszűnjön. (lásd 9. ábra)
10. Fordítsa meg az injekciós üveget, és szívja az oldatot a fecskendőbe. (lásd 10. ábra)
11. Készítse elő a betegen az injekció beadásának helyét, és fecskendezze be a készítményt a mellékelt pillangós tűvel. (lásd 11. ábra)
Az intravénás beadás sebessége 3 ml/perc legyen, de soha ne haladja meg a 10 ml/perc értéket.
A szereléket nem szabad ismételten felhasználni.
Gyermekek és serdülők
Mivel az adagolást a fenti feltételek alapján a klinikai eredmény szerint kell beállítani, a testtömeg szerinti adagolás nem tekinthető különbözőnek a felnőttekétől.
A Fanhdi biztonságosságát és hatásosságát 6 évesnél fiatalabb gyermekek esetében nem igazolták.
Ha az előírtnál több Fanhdit alkalmazott
A humán VIII. véralvadási faktor túladagolás tüneteiről mindez ideig nem számoltak be. Azonban, ha a szükségesnél több Fanhdit alkalmazott azonnal forduljon kezelőorvosához vagy gyógyszerészéhez.
Ha elfelejtette alkalmazni a Fanhdit
Alkalmazza aznap a következő adagot és folytassa az orvos által előírt rendszeres időközökben.
Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ritkán (1000-ből legfeljebb egy embert érinthetnek) az alábbi mellékhatások jelentkezhetnek a Fanhdi alkalmazása után:
- Viszketés, reakciók az injekció beadása helyén (pl. égő érzés és átmeneti pirosság)
- Allergiás reakciók (szorító érzés a mellkasban, rossz közérzet, szédülés, hányinger, és kismértékű vérnyomásesés, ami álló helyzetben szédülést okozhat).
- Furcsa szájíz
- Láz
- Szapora szívverés
Az anafilaxiás (súlyos allergiás) sokk lehetőségét nem lehet kizárni.
Ha az alábbi tünetek bármelyikét észleli az injekció beadása alatt:
- szorító érzés a mellkasban, rossz közérzet,
- szédülés,
- enyhe vérnyomásesés (ami álló helyzetben/felálláskor szédülést okozhat),
- hányinger,
ezek a túlérzékenységi és anafilaxiás reakció korai jelei lehetnek. Anafilaxiás vagy allergiás reakció esetén szakítsa meg az injekciót és azonnal forduljon orvoshoz.
A készítmény összetevőivel szembeni allergiás reakció nem zárható ki teljes mértékben.
A VIII. faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII. faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
A vírusbiztonsággal kapcsolatos tudnivalókat lásd 2. pontban.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Fanhdi injekciót tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Legfeljebb 30 °C-on tárolandó. Nem fagyasztható.
Fizikai és kémiai szempontból az elkészített oldat 25 °C-on 12 órán át stabil. Mikrobiológiai szempontból a készítményt azonnal fel kell használni. Ha nem kerül azonnal felhasználásra, a tárolás időtartama és körülményei a felhasználó felelőssége és rendszerint nem lehet több mint 24 óra 2-8 °C-on, hacsak a feloldás nem ellenőrzött és validált körülmények között történt.
Az elkészített oldat tiszta vagy enyhén opálos.
Ne alkalmazza ezt a gyógyszert, ha az oldat zavaros vagy fel nem oldott részecskéket tartalmaz. Amennyiben az elkészített oldat részecskéket tartalmaz vagy elszíneződött meg kell semmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
Minden fel nem használt maradékot és hulladékot előírásszerűen kell kezelni.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Fanhdi?
- A készítmény hatóanyaga a humán VIII. véralvadási faktor. Egy injekciós üveg 250 NE, ill. 500 NE, ill. 1000 NE humán VIII. véralvadási faktort tartalmaz.
- Egyéb összetevők: hisztidin, humán albumin, arginin és 10 ml injekcióhoz való víz (oldószer külön előretöltött fecskendőben).
Milyen a Fanhdi külleme és mit tartalmaz a csomagolás?
A Fanhdi por oldatos injekcióhoz.
Fehér vagy halványsárga színű, liofilizált port tartalmazó injekciós üveg és injekcióhoz való víz előretöltött fecskendőben (oldószer).
A készítmény feloldásához és felhasználásához a Fanhdihez adott szerelékek: szűrő, áttöltő adapter, pillangós tű és 2 alkoholos törlőkendő.
Kiszerelés: 1 injekciós üveg, 1 előretöltött fecskendő oldószerrel és szerelékekkel
A Fanhdi liofilizált por oldatos injekcióhoz. 250 NE, ill. 500 NE, ill. 1000 NE humán VIII. véralvadási faktort tartalmaz injekciós üvegenként.
A készítmény kb. 25 NE, ill. 50 NE, ill. 100 NE humán VIII. véralvadási faktort tartalmaz milliliterenként a 10 ml injekcióhoz való vízben történő feloldás után.
A Fanhdi a VIII. véralvadási faktort tartalmazó vérzéscsillapító készítmények csoportjába tartozik.
A Fanhdi hemofília A-ban (öröklött VIII. faktorhiány) kialakult vérzés kezelése vagy megelőzése alkalmazható.
A készítmény alkalmazható a szerzett (egyéb betegség/tényező miatt kialalkuló) VIII. faktorhiány kezelésére is.
Nem állnak rendelkezésre olyan adatok, melyek alapján a Fanhdi von Willebrand-betegség kezelésére ajánlható lenne.
2. Tudnivalók a Fanhdi injekció alkalmazása előtt
Ne alkalmazza a Fanhdi injekciót:
- ha allergiás a humán VIII. véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt)egyéb összetevőjére.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Figyelmeztetések és óvintézkedések
A Fanhdi alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
- Kevéssé valószínű, de fennáll annak a lehetősége, hogy súlyos anafilaxiás reakció (hirtelen kialakuló, súlyos allergiás reakció) jelentkezik. Az alábbi tünetek lehetnek a Fanhdi hatására kialakult anafilaxiás reakció jelei: bőrkiütés, testszerte jelentkező csalánkiütés, szorító érzés a mellkasban, szédülés, hányinger vagy hányás, szédülés álló helyzetben. Ha ezeket a tüneteket tapasztalja, azonnal hagyja abba a készítmény használatát és kérjen orvosi segítséget.
- Orvosa valószínűleg el fog végezni néhány vizsgálatot, hogy meggyőződjön arról, hogy a Fanhdi adag, amit Ön kap, elegendő a megfelelő VIII. faktorszint fenntartásához.
- Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII. faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem kontrollálható Önnél, illetve gyermekénél a Fanhdi-val, azonnal tájékoztassa erről kezelőorvosát.
- Ha önnél korábban VIII. faktor-inhibitorok alakultak ki és másik VIII. faktorkészítményre tér át, fennáll az inhibitorok újbóli kialakulásának kockázata.
- Ha a Fanhdi alkalmazásához szükség van centrális vénás hozzáférést biztosító eszközre (central venous access device - CVAD), akkor orvosának oda kell figyelnie a CVAD-vel kapcsolatos szövődményekre, köztük a helyi fertőzésekre, a baktériumok megjelenésére a vérben (bakterémia) és a katéter bevezetési helyén kialakuló vérrögképződésre (trombózis).
Az emberi vérből vagy plazmából előállított gyógyszerek gyártása során bizonyos intézkedéséket tesznek annak érdekében, hogy elkerüljék a fertőzések átvitelét a betegre. Ezen óvintézkedések közé tartoznak az alábbiak:
- a donorok gondos kiválasztása, annak érdekében, hogy akik a fertőzések átvitele szempontjából kockázatot jelentenek, azokat kizárják,
- az egyes vérminták és plazmakészletek vizsgálata vírusok/fertőzések jeleire,
- a vírusok hatástalanítására/eltávolítására szolgáló lépések beiktatása a gyártási eljárásba.
Az emberi vérből vagy plazmából készült gyógyszerkészítmények alkalmazása esetén, mindezek ellenére sem zárható ki teljes bizonyossággal a fertőzés átvitelének lehetősége. Ugyanez érvényes az ismeretlen vagy új vírusokra és egyéb kórokozókra.
Ezek az intézkedések hatásosak a burokkal rendelkező vírusok, például a humán immundeficiencia vírus (HIV), a (májgyulladást okozó) hepatitisz B és hepatitisz C vírus, valamint a burokkal nem rendelkező hepatitisz A vírus esetén. Az intézkedések hatékonysága korlátozott lehet a lipidburokkal nem rendelkező vírusok, pl. a parvovírus B19 ellen. A parvovírus B19 fertőzés veszélyes lehet terhes nőkre (magzati fertőzés), valamint immunhiányos betegekre és bizonyos típusú vérszegénység esetén (pl. sarlósejtes vérszegénységben vagy hemolitikus anémiában).
Ha rendszeresen kap humán plazmából előállított VIII. faktorkészítményt, kezelőorvosa lehet, hogy ajánlani fogja a hepatitisz A és B elleni védőoltást.
Ajánlott, hogy minden esetben, mikor Fanhdi-kezelésben részesül, a készítmény nevét és gyártási számát feljegyezze.
Lásd még 4. pont.
Gyermekek és serdülők
A felsorolt figyelmeztetések és óvintézkedések felnőttekre és gyermekekre is vonatkoznak.
Egyéb gyógyszerek és a Fanhdi
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
A humán VIII. véralvadási faktorkészítmények és egyéb gyógyszerek közötti kölcsönhatás nem ismert.
Terhesség, szoptatás és termékenység
A hemofília A nőkben ritkán fordul elő, emiatt a VIII. faktor terhesség és szoptatás alatti alkalmazásáról nincsen tapasztalat.
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Nincs arra utaló jel, hogy a Fanhdi hatással lenne a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre.
A Fanhdi nátriumot tartalmaz
A Fanhdi gyártási eljárásából származó maradék nátriumtartalom nem haladja meg az injekciós üvegenkénti 23 mg-ot. Ez megfelel a felnőttek számára ajánlott maximális napi nátriumbevitel 1,15%-ának. Azonban a beteg testtömegétől és az adagolástól függően a beteg egy injekciós üvegnél többet is kaphat.
3. Hogyan kell alkalmazni a Fanhdi injekciót?
Az alkalmazott Fanhdi mennyisége több tényezőtől függ, pl. az Ön testsúlyától, klinikai állapotától, a vérzés helyétől és mértékétől. A szükséges VIII. faktor-aktivitási szint eléréséhez szükséges Fanhdi adagot és az alkalmazás gyakoriságát kezelőorvosa fogja kiszámítani.
A készítményt intravénásan (vénába fecskendezve), legfeljebb 10 ml/perc sebességgel kell alkalmazni.
A kezelés időtartamát kezelőorvosa fogja meghatározni.
A kezelésre és alkalmazásra vonatkozó útmutatások
Kövesse az alábbi utasítást, hacsak kezelőorvosa más útmutatást nem adott.
A maradék készítményt nem szabad későbbi kezelésre félretenni, még hűtőszekrényben tárolva sem.
Az oldat elkészítése:
1. Melegítse fel az üvegeket maximum 30 °C-ra. (lásd 1. ábra)
2. Csatlakoztassa a dugattyút az oldószert tartalmazó fecskendőhöz. (lásd 2. ábra)
3. Vegye ki a szűrőt a csomagolásából. Vegye le a fecskendőről a zárókupakot, és csatlakoztassa a fecskendőt a szűrőhöz. (lásd 3. ábra)
4. Vegye ki az áttöltő adaptert a csomagolásból, és csatlakoztassa a szűrőhöz és a fecskendőhöz. (lásd 4. ábra)
5. Távolítsa el a kupakot az injekciós üvegről, és törölje le a dugót a mellékelt alkoholos törlővel. (lásd 5. ábra)
6. Szúrja át a dugót az áttöltő adapter tűjével. (lásd 6. ábra)
7. A teljes oldószer mennyiséget nyomja át a fecskendőből az injekciós üvegbe. (lásd. ábra)
8. Rázogassa óvatosan az injekciós üveget mindaddig, amíg a készítmény fel nem oldódik. (lásd 8. ábra) Egyéb parenterálisan alkalmazandó készítményekhez hasonlóan ne használja fel az oldatot, ha az oldódás nem tökéletes vagy az oldatban részecskék láthatók.
9. Rövid időre válassza szét a fecskendőt és a szűrőt az injekciós üvegtől és az áttöltő adaptertől, hogy a vákuum megszűnjön. (lásd 9. ábra)
10. Fordítsa meg az injekciós üveget, és szívja az oldatot a fecskendőbe. (lásd 10. ábra)
11. Készítse elő a betegen az injekció beadásának helyét, és fecskendezze be a készítményt a mellékelt pillangós tűvel. (lásd 11. ábra)
Az intravénás beadás sebessége 3 ml/perc legyen, de soha ne haladja meg a 10 ml/perc értéket.
A szereléket nem szabad ismételten felhasználni.

Gyermekek és serdülők
Mivel az adagolást a fenti feltételek alapján a klinikai eredmény szerint kell beállítani, a testtömeg szerinti adagolás nem tekinthető különbözőnek a felnőttekétől.
A Fanhdi biztonságosságát és hatásosságát 6 évesnél fiatalabb gyermekek esetében nem igazolták.
Ha az előírtnál több Fanhdit alkalmazott
A humán VIII. véralvadási faktor túladagolás tüneteiről mindez ideig nem számoltak be. Azonban, ha a szükségesnél több Fanhdit alkalmazott azonnal forduljon kezelőorvosához vagy gyógyszerészéhez.
Ha elfelejtette alkalmazni a Fanhdit
Alkalmazza aznap a következő adagot és folytassa az orvos által előírt rendszeres időközökben.
Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ritkán (1000-ből legfeljebb egy embert érinthetnek) az alábbi mellékhatások jelentkezhetnek a Fanhdi alkalmazása után:
- Viszketés, reakciók az injekció beadása helyén (pl. égő érzés és átmeneti pirosság)
- Allergiás reakciók (szorító érzés a mellkasban, rossz közérzet, szédülés, hányinger, és kismértékű vérnyomásesés, ami álló helyzetben szédülést okozhat).
- Furcsa szájíz
- Láz
- Szapora szívverés
Az anafilaxiás (súlyos allergiás) sokk lehetőségét nem lehet kizárni.
Ha az alábbi tünetek bármelyikét észleli az injekció beadása alatt:
- szorító érzés a mellkasban, rossz közérzet,
- szédülés,
- enyhe vérnyomásesés (ami álló helyzetben/felálláskor szédülést okozhat),
- hányinger,
ezek a túlérzékenységi és anafilaxiás reakció korai jelei lehetnek. Anafilaxiás vagy allergiás reakció esetén szakítsa meg az injekciót és azonnal forduljon orvoshoz.
A készítmény összetevőivel szembeni allergiás reakció nem zárható ki teljes mértékben.
A VIII. faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII. faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
A vírusbiztonsággal kapcsolatos tudnivalókat lásd 2. pontban.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Fanhdi injekciót tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Legfeljebb 30 °C-on tárolandó. Nem fagyasztható.
Fizikai és kémiai szempontból az elkészített oldat 25 °C-on 12 órán át stabil. Mikrobiológiai szempontból a készítményt azonnal fel kell használni. Ha nem kerül azonnal felhasználásra, a tárolás időtartama és körülményei a felhasználó felelőssége és rendszerint nem lehet több mint 24 óra 2-8 °C-on, hacsak a feloldás nem ellenőrzött és validált körülmények között történt.
Az elkészített oldat tiszta vagy enyhén opálos.
Ne alkalmazza ezt a gyógyszert, ha az oldat zavaros vagy fel nem oldott részecskéket tartalmaz. Amennyiben az elkészített oldat részecskéket tartalmaz vagy elszíneződött meg kell semmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
Minden fel nem használt maradékot és hulladékot előírásszerűen kell kezelni.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Fanhdi?
- A készítmény hatóanyaga a humán VIII. véralvadási faktor. Egy injekciós üveg 250 NE, ill. 500 NE, ill. 1000 NE humán VIII. véralvadási faktort tartalmaz.
- Egyéb összetevők: hisztidin, humán albumin, arginin és 10 ml injekcióhoz való víz (oldószer külön előretöltött fecskendőben).
Milyen a Fanhdi külleme és mit tartalmaz a csomagolás?
A Fanhdi por oldatos injekcióhoz.
Fehér vagy halványsárga színű, liofilizált port tartalmazó injekciós üveg és injekcióhoz való víz előretöltött fecskendőben (oldószer).
A készítmény feloldásához és felhasználásához a Fanhdihez adott szerelékek: szűrő, áttöltő adapter, pillangós tű és 2 alkoholos törlőkendő.
Kiszerelés: 1 injekciós üveg, 1 előretöltött fecskendő oldószerrel és szerelékekkel
Fogyasztói ár:
25430Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 25430 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2025
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2025


















